Limites na Solubilização de Substâncias
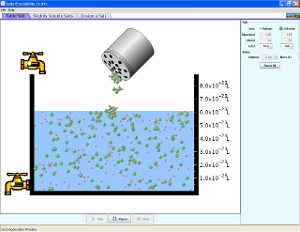
Sabemos que algumas misturas de substancias se dão em qualquer proporção. É o caso dos gases. Estes sempre formam soluções (misturas homogêneas), não importando a quantidade dos componentes. Deve-se notar que as soluções gasosas se estabelecem por simples difusão dos gases e não por interações soluto-solvente como nos casos vistos anteriormente. Os gases podem se dissolver em líquidos ou em sólidos. E neste caso há uma proporção certa de solubilização que depende da interação do soluto gasoso-solvente e também de condições de temperatura e pressão. A temperatura afeta também a solubilidade de solutos líquidos e sólidos. Geralmente a substância dissolve até um certo limite em um solvente em determinadas condições de temperatura e pressão. Quando atingido este limite dizemos que a solução está saturada. A adição de mais soluto não altera a concentração da solução. Estabelece-se um equilíbrio na velocidade da dissolução e condensação do soluto. Isto significa que a medida que “entram partículas” na solução também “saem partículas”. (Maldaner, 1997 p.40).
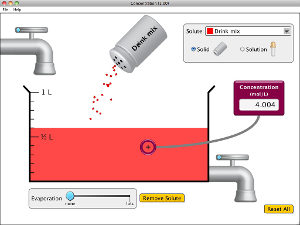
Gostaria de sugerir duas ilustrações para podermos analisar isso de forma microscópicas, usando dois simuladores que simula a solubilização até a saturação.
OBS: Esses recursos só serão visualizado se seu computador estiver com plugin JAVA atualizado. Clique aqui para obter informações para instalar o JAVA.
Atividade
1) O que significa os números dissolvidos e sólido que aparecem na animação? Que relação pode ser feito com a solubilidade do cloreto de sódio.
2) Ao utilizar o identificador de concentração em um dos objetos, o que pode ser observado quando a solução está saturada e se adiciona mais soluto? Por que isso ocorre?
3) As partículas que estão no estado sólido permanecem inalterada o tempo todo ou existe troca de interações entre o solvente? Explique.
Sob licença Creative Commons Attribution Non-commercial Share Alike 3.0 License