Agregação
Uma das características que percebemos são as fases que a matéria pode ser encontrada. No caso como estamos analisando a água é fácil dar exemplos de situações na qual encontramos essa substância nos estados sólidos, líquidos e gasosos.
Mas o que caracteriza quais as condições que podem estar por trás para que a água esteja nessas agregações?
Saber diferenciar sólido, líquido e gasoso não é algo muito difícil, mas como defini-los?
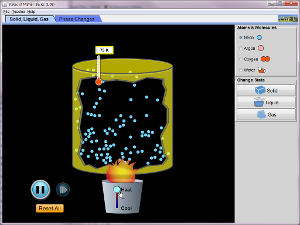
Explore o simulador abaixo e fique atento nas mudanças ocasionadas pela variação de temperatura e pressão.
Sólidos: O sólido se caracteriza por um arranjo interno regularmente ordenado. Dizemos que possui estrutura cristalina e as partículas constituintes estão fortemente interligadas. Estes cristais diferem entre si e há arranjos característicos para cada sólido, dependendo de como estão unidos (átomos, íons, moléculas) e as forças que as mantêm unidas. Há então quatro tipos de sólidos: iônicos, moleculares, covalentes e metálicos (MALDANER, 1997, p. 29).
Como estamos analisando a água temos a interação de sólidos moleculares, as estruturas são moléculas. Para haver moléculas devem haver ligações covalentes entre os átomos que as constituem. O sólido molecular tem também outro tipo de força entre as moléculas que o constituem (forças intermoleculares). Essas forças são devido a proximidade entre as moléculas, e são de natureza elétrica (MALDANER, 1997, p. 30). Em especial temos a água uma molécula polar então a interação, dipolo-permanente dipolo-permanente e temos ainda uma diferença de eletronegatividade entre os átomos que a constituem “H – O”, dando origem à interação do tipo ligação de hidrogênio (rever conteúdo do 1ºano – Forças Intermoleculares).
Líquidos: Os líquidos podem ser obtidos por fusão de um sólido ou condensação de um gás. No primeiro caso algumas forças são rompidas e, no outro, forças são estabelecidas. A proximidade das partículas constituintes do líquido supõe forças intermoleculares e a desordem relativa mostra que estas forças são relativamente fracas, pois dá ampla liberdade de as moléculas fluírem e também difundirem. Os líquidos possuem algumas propriedades explicadas por essa desordem que são: capacidade de escoamento; difusão lenta; pouca compressibilidade; volume constante; tensão superficial (MALDANER, 1997. p. 34).
Atividade
1) No software que você utilizou, procure explicar com suas palavras qual a diferença que se pode perceber nos estados físicos: sólido, líquido e gasoso na molécula da água.
2) Selecione molécula água no OAs, e o estado sólido. Com o mouse aumente a temperatura analisando atentamente, e descreva suas observações.
3) A temperatura pode influenciar no estado físico da água?
Sob licença Creative Commons Attribution Non-commercial Share Alike 3.0 License